Урок №81. Задания №34 (комплексное)

Информация о загрузке и деталях видео Урок №81. Задания №34 (комплексное)
Автор:
Екатерина СтрогановаДата публикации:
25.03.2025Просмотров:
513Описание:
Тайм-коды: 0:00:00 - Введение 0:02:46 - Задача 34.1 0:26:39 - Задача 34.2 0:53:10 - Задача 34.3 1:29:26 - Ответы на вопросы
Транскрибация видео
Ну что, ребят, всем привет, там Добротин правду говорит, кто сегодня онлайн, того сотка на ЕГЭ будет, это инфа сотка, прям 100%.
Ну что, всем привет, товарищи, мы сегодня с вами в стандартной обстановке, уже, может быть, не такой природной, не такой какой-то солнечной, но какая есть.
Теперь у нас сугубо рабочие будни, и осталось два месяца до экзамена, и мы эти два месяца будем проводить с вами в интенсивнейшей работе, потому что у нас еще очень много всего интересного и очень всего важного.
Всем привет!
Ну что, как ваши дела?
Отдохнули в воскресенье, да, потому что вчера никаких уроков не было.
Надеюсь, что вы использовали воскресенье с пользой для себя, так сказать.
Может быть, кто-то долги закрыл, может быть, кто-то отдохнул.
Потому что, ребят, отдых — это очень важно.
Хотя, честно скажу, что такие поездки — это вообще не про отдых, потому что это был отдых плюс...
Конечно, работа, но это такой отдых за счёт смены деятельности и за счёт смены обстановки, а не за счёт какого-то именно физического отдыха, то есть такой больше эмоционально-интеллектуальный отдых, я бы сказала.
Но в любом случае за счёт смены деятельности я как-то вдохновилась, как-то так, в общем, замотивировалась, такая «О, два месяца, ещё точно дотянем, точно доработаем с чувством, с толком, с расстановкой, столько всего хочется ещё сделать, поэтому отдыхать — это важно».
Если вдруг вы чувствуете, что ну вот вообще не могу, вот просто ничего не хочу, ничего не получается, тогда один день нужно всё отключить, всё убрать и делать то, что вы хотите.
Вот просто немножечко отстраниться от всего, и этого одного дня очень часто более чем достаточно, чтобы потом более как-то эффективно, более вовлечённо делать свои дела.
Ну что, тогда с вас перекличка, давайте начинать, потому что у нас сегодня насыщенная программа.
Сегодня мы с вами решаем 34-ю задачу на, так сказать, сложное разложение, если можно назвать так, на параллельное разложение.
В том числе мы будем сегодня с вами решать 34-ю задачу на параллельное разложение из настоящего ЕГЭ 2024 года, это разложение хлоратов.
Ну и будем решать классику от разложения нитратов.
И вот то, что вы у меня часто спрашиваете, Катя, что там в конспекте написано, что нитраты кальция и бария могут разлагаться с образованием нитрита или оксида, то это как раз и про это.
И вот сегодня будем вспоминать в том числе этот моментик.
Яростный плюсик в чат имеем.
Все?
Супер.
Тогда давайте начинать.
Готовы?
Все хорошо?
Все отлично?
У нас эта неделя насыщенная на уроки, но что же поделать, зато вчера отдыхали.
Итак, задачка из ЕГЭ 24-го года.
Что мы делаем?
Мы не скулим.
Самое главное — не бояться.
Пишите «дано» по мере прочитывания условия задачи.
Итак, навеску.
Хлоратокалия.
Кстати, какое тривиальное название.
Массой такой-то осторожно нагрели, пишем.
Масса калий-хлор-О3 17,15 грамма.
Осторожно нагрели, аккуратно нагрели, что может быть будут какие-то разные продукты разложения.
И говорят дальше.
При этом часть соли подверглась диспропорционированию, а часть разложилась с выделением газа, а часть не разложилась.
Видите, у вас аж три ситуации, как разлагается хлораткалия-бертолетовая соль.
Можем сразу нарисовать картиночку, что вот у нас была бертолетовая соль, которая используется в спичках, и что у нас есть три пути.
Первый путь – это диспропорционирование.
Тогда какая реакция будет протекать, если диспропорционирование?
Значит, хлор будет сам себя окислять и сам себя восстанавливать.
Восстанавливает он себя в таких реакциях всегда до минус 1.
А окисляет до более высокой степени окисления, до плюс 7, и будет получаться перхлорат.
Поставим коэффициенты.
Чтобы уравнять кислород, просто перемножьте 3 и 4.
Сюда 4, сюда 3, здесь тогда 1.
Давайте пометим, что первое диспропорционирование, вот такие у нас продукты.
Второй путь с выделением газа.
Тогда какая реакция?
Какой газ здесь будет образовываться?
Кислород.
Почему?
А потому что хлор плюс 5 это кислитель, а единственный восстановитель, который есть в этом веществе, это только кислород минимальной степени окисления.
Поэтому хлор восстанавливается также до минимальной степени окисления, а кислород окисляется до нуля.
Как уравняем?
Перемножьте двойку и тройку.
Сюда поставите двойку, сюда поставите двойку, сюда поставите тройку.
Вот это второй путь протекания реакции.
И что мы с вами обсуждали в базовых уроках?
То, что без катализатора у нас идет диспропорционирование, а с катализатором идет окисление кислорода.
И да, конечно, если вы добавите катализатор, то у вас практически все продукты, это будет калий-хлор и кислород.
А если вы не добавите катализатор, то у вас может быть смесь продуктов.
И так, и так.
Это и есть как раз-таки момент с параллельным разложением.
Что всегда могут идти какие-то другие побочные процессы, и получается смесь продуктов.
А вообще третья часть у нас даже и не разложилась, так и осталась в виде калий, хлор, О3.
И вот такие вот задачки были на ЕГЭ в прошлом году, они все были однотипные.
И да, в том числе вчера ВКонтакте тоже такое выкладывалось.
Но это другая задача, здесь другие значения, поэтому если вдруг не решали, не страшно.
Отработайте сейчас этот алгоритм, потом решите похожий по аналогии.
Масса образовавшегося твердого остатка составила столько-то граммов.
Твердый остаток из чего будет состоять?
Вот из этого всего.
То есть это масса смеси, которая получилась после реакции разложения.
Получается 14,75 грамма.
Этот остаток растворили в воде.
Объем воды 130 миллилитров.
И получили раствор с массой вдоль хлорида калия столько-то.
3,22% Вычислите массовую долю хлорат ионов в твердом остатке, образовавшемся при прокаливании хлората калия.
То есть нам нужно найти массовую долю хлорат ионов.
Обратите внимание, то есть хлор О3 заряда минус вопрос.
Ну и по факту, если в твердом остатке, то нам нужно найти именно отсюда эти хлорат ионы.
Все.
Тут есть еще какие-то реакции, как вы думаете?
За реакции мы получили баллы?
Если катализатор, да, только вторая реакция.
Но здесь его нету, поэтому идут параллельные реакции, параллельное разложение, смесь продуктов.
Впрочем, здесь как раз-таки и об этом и сказали.
Да, получили, больше никаких реакций нету, потому что когда вот этот твердый остаток, который состоит из разных веществ,
Растворили в воде?
Там идет какая-то реакция?
Нет.
У вас просто растворимые в воде соли, и у вас получается раствор солей.
Поэтому нет никакой больше реакции.
У нас не протекает.
И один балл мы уже точно с вами заработали.
Но давайте с вами подумаем немножко от обратного.
Что нам нужно знать, чтобы в итоге найти финальный ответ?
Нам нужно знать количество хлорат-анионов в воде.
оставшимся остатки, в твердом остатке, который получился после разложения.
А чтобы знать количество вещества хлоратов, нам нужно знать количество вещества хлората калия, то есть всей соли, всего вещества.
Затем, зная количество вещества хлоратов, мы найдем массу, а массу твердого остатка мы и так знаем, это масса смеси, и это будет наш финальный ответ.
Ну и каким-то образом нам нужно из всех этих значений найти количество вещества хлората,
оставшегося хлората калия, оставшейся бертолетовой соли.
С чего начнем?
Что мы можем сейчас с вами посчитать?
Ну, во-первых, мы можем посчитать, сколько хлората было изначально.
Скорее всего, нам это как-то пригодится.
Ну, давайте считать.
Калий, хлор, О3.
Для этого нам нужно массу 17,15 разделить на малярную массу.
А малярная масса чему равна?
Напишите быстрее меня в чате.
39 плюс 35,5 плюс 3 на 16.
Получается 125,5.
0,14 моль.
Получилось?
Должно получиться.
Тогда что дальше?
Мы можем посчитать массу хлорида калия.
Почему?
Потому что масса твердого остатка, вы же знаете, это 14,75 грамма.
С одной стороны, вы знаете массу воды и вы знаете массовую долю, то есть вы всё знаете, чтобы посчитать, сколько там было хлорида.
Тогда масса раствора, которая получилась после растворения этого твёрдого остатка, это масса воды.
Плюс масса остатка.
Или масса смеси, как я ее изначально обозначила.
Абсолютно не важно, как вы ее будете обозначать.
Получается 130 граммов у нас объем совпадает с массой плотность единицы.
Плюс 14,75.
Согласны?
144,75 грамм.
Тогда масса калий-хлор...
конечном растворе это произведение массовой доли 0 0 3 2 2 на массу раствора 144,75
Получается 0,0322 умножить на 144,75.
У меня получилось вот столько.
4,66 грамма.
Ну и понятное дело, что нам нужно количество вещества.
То есть нам же потом в любом случае нужно делать расчеты через ν. Давайте найдем сразу ν-калихлор.
Для этого массу 4,66 нужно разделить на малярную массу.
А малярная масса хлорида это 74,5 грамма.
Сколько у вас получилось?
У меня получилось... Так, давайте я удалю эти знаки после запятой.
Просто возьмем 4,66.
Тогда, если мы так разделим... Хотя нет, лучше не стало.
Там довольно-таки много знаков после запятой.
Но давайте подумаем, до какого знака мы будем округлять.
Смотрите, там 0,6255.
Ну, я бы округлила, наверное, пятерку до шестерки.
Потому что слишком много знаков после запятой тоже не хочется таскать.
Хотя, конечно, можно было бы до пятерки округлить, но как будто бы смысла особо нет.
Но пусть будет тогда 0, 0, 6, 2, 6.
Согласны?
Ну или можно до тройки округлить, в принципе.
Давайте до тройки.
Давайте до хотя бы третьего знака, потому что реально десятитысячную таскать как будто бы слишком много.
В чем сложность?
Просто чем меньше знаков вы берете, тем чуть менее точно у вас будет финальный ответ.
Но поскольку мы с точки зрения округления все делаем правильно, то вам точно дадут максимальный балл в конце.
Итак, хлорид нашли.
И мы понимаем, что этот хлорид образуется по двум реакциям.
Что еще мы можем с вами посчитать?
Вот как будто бы больше ничего, но, ребята, тут есть очень такая важная тонкая мысль.
Смотрите, вы знаете массу начальной навески, начального нашего твердого вещества.
И знаете массу конечного твердого вещества.
А за счет чего у вас меняется масса твердого вещества?
А за счет того, что вот здесь у вас удаляется газ.
И это единственное вещество, которое в итоге уходит из этой твердой смеси.
Поэтому по разности масса начальная минус масса конечная мы можем найти массу кислорода.
А поскольку кислород...
получается только по одной реакции, то мы дальше сможем сделать расчёт уже по второй реакции.
И вот здесь это действительно нужно почувствовать, это нужно увидеть.
Вот вы сейчас с этим познакомились, если у вас будут какие-то похожие элементы или похожая задачка, нужно будет воспроизвести этот элемент.
Договорились?
Давайте считать кислород.
Получается, что масса кислорода это масса начального хлората минус масса твердого остатка минус масса смеси.
И это 17,15 минус 14,75.
Напишите, какое количество вещества кислорода у вас получилось.
Итак, масса кислорода 17,15 минус
14,75 это 2,4.
Количество вещества кислорода.
Это масса кислорода 2,4.
Делено на малярную массу на 32.
У меня получилось 0075.
Получилось.
Все супер.
Ну, значит, мы точно все пока правильно с вами делаем.
Что дальше?
А дальше расчеты.
Ну, то есть, если кислорода у нас 0075, тогда хлорида по этой реакции сколько?
В 2 трети раза больше.
То есть, мы делим это значение на 3 и умножаем на 2.
Просто расчет по уравнению реакции.
И получается 005 моль.
Тогда, если мы знаем, сколько всего было хлорида, знаем, сколько по второй реакции, что мы можем найти?
Сколько по первой реакции.
Согласны?
Сколько по первой?
Отнимаем.
Получается 0,063 и 0,05.
Это 0,013 моль.
Тогда мы можем найти, сколько у нас перхлората получилось в 3 раза больше.
0013 умножаем на 3.
Получается 0039.
А если мы вот это вот все знаем, то мы тогда сможем найти и оставшийся хлорат.
Правда?
Поэтому практически задача решена.
Больше здесь особо ничего делать не нужно.
А расчеты по уравнению реакции прописывать не обязательно.
Ну, если вам хочется, то, конечно, пропишите, что, например, НЮ2 калий-хлор, оно у нас равно 2 третьих количества вещества кислорода.
И это 2 третьих умножить на 0, 0, 7, 5.
И это получается у нас 0, 0, 5.
тогда количество вещества калий хлор по первой реакции это весь калий хлор то есть 0063 то что мы нашли через раствор минус тот который получился по второй реакции и тогда количество вещества калий хлор о4 и
Это 3 ν1 калий-хлор.
Значит, мы 3 умножаем на 0,013 моль.
И получается 0,039 моль.
Теперь, если мы знаем массу всего твердого остатка, мы найдем массу калий-хлор, найдем массу перхлората и найдем оставшийся хлорат.
Все.
Считаем.
Массу калий-хлор мы знаем.
Ее не надо как-то отдельно просчитывать, потому что сколько было в растворе, да, столько у нас и в твердом остатке.
В растворе никаких реакций у нас не было.
Тогда мы можем найти массу перхлората.
Калий, хлор, О4.
Для этого умножаем количество вещества на малярную массу.
Какая-то малярная.
39 плюс 35,5.
И плюс 4 на 16.
У меня получилось 138,5.
Умножаем на 0,039.
Получается 5,4 примерно.
Тогда масса оставшегося калий-хлору-3 это масса всего твердого остатка 14,75.
Или если не наглядно, тогда пропишите формулы, что это масса смеси.
минус масса калий-хлор, который у нас получился после разложения, который мы нашли через массовую долю, и минус масса калий-хлор О4, который мы нашли по уравнению реакции.
Тогда 14,75, мы отнимаем калий-хлор, это 4,66, и отнимаем перхлорат, это 5,4.
Сколько получилось?
1475 минус 466 минус 54 у меня получилось 469 грамма конечно нужно будет найти количество вещества но смотрите количество вещества хлората она такой же как и количество вещества хлоратокалия потому что в одном хлорате
В одной соли у вас один анион, поэтому соотношение один к одному, количество вещества совпадает.
Я хочу просто сразу все это оформить.
А количество вещества соли вы считаете как масса 4,69, деленное на малярную массу.
Малярную массу мы уже с вами считали, это 125,5.
Ну, проверяем.
Получается примерно вот столько.
0, 0, 3, 8, я бы сказала.
Ну, там какие-то знаки после запятой, но после восьмерки тройка, в принципе, можно и до такого знака тоже округлить.
Это моль.
Но мы же хотим массовую долю, поэтому нужно знать массу.
И тогда масса, именно хлорат анионов, да, как бы оставшихся, можно их как-то там тоже оставшиеся пометить.
Это количество вещества на малярную массу.
И получается, что количество вещества у нас вот такое.
Вот и куча знаков после запятой.
В принципе, их удалять можно... Не удалять.
Можете взять поточнее.
Малярная масса это 35,5 плюс 3 на 16.
83,5.
Умножайте на 83,5.
Но если округлить, то тогда получается вот такой вот ответ.
3,173 грамма.
Получилось?
Какой финальный ответ?
Массовая доля хлору-3 заряда минус именно в оставшейся смеси после разложения.
Это масса хлору-3 заряда минус делена на массу вот этой смеси.
И получается, что 3,173 мы делим на массу смеси 14,75.
У меня получилось вот столько.
0, 2, 1, 5, 1 примерно.
Давайте до второго знака округлим.
21,51.
Почему у нас разные ответы?
Почему 125?
У чего?
122,5.
Давайте еще раз проверим малярную массу.
39 плюс 35,5 плюс 3 на 16.
125,5 малярная масса.
Я думаю, что если бы здесь сразу какое-то странное значение получилось, это было бы странно.
Здесь я подставила что?
122,5.
Давайте еще раз перепроверим.
469 делю на 122,5.
Нет, все правильно.
Почему на массу смеси делим, пупсик?
А потому что, читаем, что вычислить массовую долю хлорат ионов в твердом остатке, образовавшемся при прокаливании хлората калия.
То есть нас интересовали вот именно вот эти вот хлораты.
Поэтому мы делили на массу твердого остатка, то, что получилось после разложения.
Вот с этой точки зрения эта задачка...
неприятное, потому что когда я делала разбор домашки, я сначала первый раз неправильно прочитала.
Вот просто из-за ошибок по невнимательности можно посчитать что-то абсолютно другое, а спрашивали третий.
Поэтому всегда подчёркивайте то, что вам нужно найти, чтобы не терять этот фокус внимания, чтобы в итоге не запутаться и не забыть, что вам нужно было посчитать.
Поэтому делили на массу остатков.
Можно это на ЕГЭ, но это было на ЕГЭ 24-го года.
Если, может быть, какие-то округления не так сильно округлять, да, и оставлять больше знаков после запятой, может быть, и будет 22,6.
Но вроде бы, если оставить такие знаки, которые мы оставили, такой ответ, и у ребят тоже так сошлось, но я думаю, что это правильно.
Ну, так... Эта задача...
От ребят, которые ходили на экзамены.
И, ребят, ну мы же её правильно решили.
Тут как бы критическое мышление тоже включайте, поэтому, конечно, у нас правильно.
Ну так мы же её тоже решаем, и у нас так же правильно всё.
Как мы перешли к кислороду?
Перешли к кислороду, видя, что у нас есть масса твёрдого вещества начального и видя, что у нас есть масса твёрдого остатка.
А за счёт чего у вас меняется масса?
Только за счёт того, что удаляется газ.
Потому что всё, что твёрдое, оно так и осталось в твёрдом остатке.
И вот за счёт этой разности мы можем посчитать кислород, а кислород только по второй реакции, поэтому дальше можем делать какие-то расчёты.
Мы все количество вещества использовали.
Хотя... Массу начального хлората... Мы не использовали.
Мы ее использовали только для того, чтобы посчитать кислород.
Нет, это лишнее действие.
Его, в принципе, можно тогда и убрать, если мы его этого не использовали.
Зачем оно нам нужно?
Мы оставшиеся нашли с вами как остаток плюс хлорид и плюс перхлорат.
Тут могут отличаться финальные ответы из-за того, что очень нехорошее округление.
Поэтому отличие в 1% это нормально.
Потому что мы округляли довольно-таки сильно.
У нас было очень много знаков после запятой.
Но ход решения правильный?
Правильный.
Ну что, вопросы у матросов есть, идем дальше.
Но тут на что нужно обратить внимание?
Конечно, вряд ли вам встретится уже прям идентичная задачка.
Ну и если может быть встретится, то может быть дадут малярную концентрацию, и будет как будто бы новый формат, и как будто бы под ЕГЭ 2025 года, потому что в этом году вам 100% дадут малярную концентрацию.
Но тут есть полезные мысли, которые могут перекочевать в другие задачи.
Первая полезная мысль – то, что у вас разлагается одно вещество, но направления реакции могут быть разные.
У вас есть направление диспропорционирования, есть направление с выделением кислорода.
Это так называемая параллельная реакция разложения.
Это первое.
Вторая полезная мысль из этой задачи, прям можете для себя подчеркнуть, как-то отметить отдельно, то, что если у вас есть масса твердого вещества начального, и у вас есть масса остатка, то вот эта вот разница возникает за счет выделения газообразных продуктов.
И вы можете найти какие-то газы, и потом, например, если это только один газ, посчитать его количество вещества.
Если, может быть, смесь газов, это, возможно, будет путь к уравнениям, к какой-нибудь системе уравнений или уравнений с одной неизвестной по смыслу задания.
И так далее, и так далее.
Ну, а дальше всё вполне себе стандартно.
Ещё один интересный момент, то, что здесь нужно было считать массовую долю именно анионов.
А какая разница?
Ну, анион...
Ну, это условно то же самое, что соль, только без катиона.
Ну, вы нашли количество вещества аниона, да, и здесь нам повезло, что у вас в одной соли один хлорат.
И потом нашли его массу, это количество вещества на малярную массу.
Всё.
Тогда давайте сделаем перекличку, переходим к следующей задаче, если больше вопросов нет.
Масса твёрдого остатка в сумме.
Это остаток по всем процессам.
И не по первой, не по второй реакции, а в сумме.
Всё, идём дальше.
Следующая задачка, тоже классика.
Это первый раз попалось на ЕГЭ 2022 года на досроке.
И потенциально оно может попасться и вам.
Но как-то может быть видоизменённо.
Нитрат бария медленно нагрели.
Медленно, аккуратно.
То есть тут надо сразу быть на чеку.
При этом образовался твёрдый остаток, состоящий из смеси оксида бария и нитрита бария.
И выделилась смесь газа.
Опять же, это про что?
Это про параллельное разложение.
Что вот у вас есть нитрат бария.
Барий-НО3 дважды.
И если его медленно разлагают, то может получиться не очень устойчивый промежуточный продукт нитрит.
И нам здесь на это как раз-таки намекают, что часть разложилась с образованием нитрита и кислорода.
Но все-таки нитрит двуовалентных металлов это не самое устойчивое вещество, поэтому оно может дальше разлагаться.
И в конечном счете получается оксид металла, НО2 и кислород.
И здесь тоже идут вот эти параллельные реакции.
И вот когда вы мне задаете вопрос, причем в последнее время мне человека три написало в личку, а как писать?
По смыслу задания.
Ну, то есть в тестовой части наверняка вам дадут разложение с образованием оксидов и кислорода.
А во второй части нужно смотреть.
Если, например, в 31 задании вам скажут, нитрат бария аккуратно нагрели, образовавшийся продукт растворили в воде, и потом, допустим,
К образовавшемуся раствору добавили какой-то там восстановитель или окислитель, ну, значит, у вас был нитрит, и, значит, у вас будет какая-то ОВР с нитритом.
А если сказали, что просто разложение до постоянной массы, то есть до конца, ну, значит, у вас точно оксид, НО2 и кислород, и никаких других продуктов нету.
И потом, если барьер реагирует с водой, то получается щелочь, и потом тоже что-то дальше происходит.
То есть такой момент могут ставить и в 31 задание, но чаще это больше информация для 34.
И вот как раз таки это было на ЕГЭ прошлых лет.
Давайте коэффициенты ставить.
Получается, что здесь коэффициенты не нужны.
А здесь нам нужно сделать четным кислород тут.
Тогда сюда мы поставим двойку, сюда мы поставим четверку.
И перед кислородом вроде бы единицы.
Давайте проверим.
3 на 2 – 6, на 2 – 12.
И здесь тоже получилось 12.
Смесь газов пропустили через раствор гидроксида натрия с малярной концентрацией такой-то.
Какая смесь у нас получилась?
То есть давайте рисовать картинку, что вот у нас был нитрат бария, тоже твердое вещество барий, NO3 дважды.
Его разложили.
И в результате у нас с одной стороны получается нитрит и кислород, а с другой стороны получается оксид, NO2 и кислород.
Но газы-то это только кислород и NO2.
И вот газы именно собрали.
Давайте прям для себя выделим, чтобы опять же смотреть только на них.
И пропустили через щелочь.
Через раствор щелочи.
И сейчас мы будем с вами записывать дано, потому что наконец у нас получились какие-то числовые значения.
У нас раствор натрий OH.
Какая будет идти реакция?
Как вы думаете?
Что я здесь запишу?
Натрий OH плюс что?
Кислород?
Нет, конечно, щелочь не реагирует с кислородом.
Только NO2?
Тоже нет.
Потому что у нас смесь газов, и NO2, если пропускается кислителем, окисляется до 5, и в результате получается только нитрат и вода.
Согласны?
Натрий, NO3 плюс H2O.
Потому что NO2, да, кислотный оксид, если бы кислорода не было, то получился бы нитрит и нитрат.
Но так как есть кислород, то азот 3 не может получиться.
Кислород окисляет азот до максимума, до 5.
Поэтому только нитрат.
Поскольку кислород 4 электрона принимает, поэтому сюда мы поставим коэффициенты четверки.
А азот 1 электрон отдает, поэтому сюда единичку, сюда четверку, сюда двоечку.
Вроде бы все уравнялось.
И давайте наконец-то писать дано.
Потому что у нас есть какие-то значения.
Смесь газа пропустили через раствор.
Через миллилитры граммов не должно быть.
Объем раствора натрия OH 328,11 миллилитра.
С малярной концентрацией такой-то.
Малярная концентрация ТС на 3 OH.
6, 0, 95 моль на литр.
Плотность раствора.
Щелочи, конечно же.
1, 21, 91 моль.
Грамм на миллилитр.
При этом массовая доля гидроксида натрия в растворе уменьшилась 4 раза.
То есть какая-то массовая доля штрих натрия.
Уменьшилась 4 раза.
Пока непонятно, что мы можем написать с вами.
Массовая доля штрих делена на массовую долю какую-то 1, начальную долю.
1 к 4.
То есть, начально мы можем посчитать, зная концентрацию, объем, плотность.
То есть, это можно сделать просто не в одно действие, но можем.
А тогда мы сможем потом посчитать, сколько в конечном счете.
А объем непрореагирующего газа оказался 8 раз меньше объема исходной смеси газов.
Непрореагирующего.
Пока, допустим, мы не понимаем, что это за непрореагирующий газ.
Но делена на начальную смесь.
8 раз меньше.
То есть 1 восьмая.
Вычислите массу исходного нитрата бария.
Масса бария 3 дважды.
Вопрос.
Все.
Все записали.
Вопросы сейчас есть.
Давайте порассуждаем над тем, а какой у нас будет непререгирующий газ.
Смесь, опять же, это NO2 и кислород.
И, ребят, тут нужно заметить одну очень важную вещь.
Тут, знаете, реально надо глаза пошире, так сказать, чтобы больше информации впитывать.
И заметить одну интересную вещь.
Что у вас NO2 и кислород по второй реакции получается соотношение 4 к 1.
Согласны?
А по третьей реакции у вас поглощаются газы также в соотношении 4 к 1.
То есть получается, что у вас все то, что получилось по второй реакции, именно оно и поглотится щелочью с образованием нитрата.
А на этот кислород, который получился по первой реакции, у вас Н2 нет.
Потому что Н2 в сумме по двум реакциям получается меньше его в недостатке.
И поэтому непрореагирующий газ, который у нас тут остался, это именно кислород.
И здесь даже можно поточнее написать, что это весь кислород, который получился по первой реакции.
Давайте мы тут и напишем это сразу.
Потому что это важно.
Что это именно В1 кислорода.
Я понимаю, что это та штука, которую далеко не сразу можно увидеть.
Но это опять же такая особенность, которую сейчас вам нужно заметить.
И иметь в виду для дальнейших расчетов.
Что может быть у вас будут какие-то другие похожие задачки.
Что у вас там идут какие-то параллельные процессы.
Что-то там пропускается.
И вы видите, что где-то соотношение такое же, как и в другой реакции.
И получается, что вот это вот все поглотилось щелочью, а газ, который остался, это кислород по первой реакции.
Ну все.
С чего мы начнем с вами решать?
Давайте подумаем, а что мы должны найти, чтобы найти массу нитрата бария.
Конечно, для этого нужно знать количество вещества.
И, судя по всему, мы будем искать количество вещества по первой реакции через оставшийся кислород.
а по второй реакции через вот эти вот газы.
То есть в итоге нам нужно хорошо поработать с третьей реакцией, с газами, которые поглотились, со щелочью, чтобы перейти к первой, ко второй реакции.
В целом мы решили задачу в уме.
Итак, перекличка, что все готовы.
На старт, внимание, марш.
Кто-то, кто чувствует в себе силу уверенности, идите вперед, чтобы у нас был финальный ответ, потому что у меня ответов нет.
И будем друг друга проверять.
Нет, это не обязательно в условии оформлять.
Вы догадались, и прекрасно, вы потом просто будете считать как данность.
Это не обязательно объяснять кому-то, потому что в целом это умному человеку, выпускнику, понятно по реакции.
Все супер.
Давайте работать со щелочью тогда.
Что мы с вами можем посчитать?
Мы с вами можем посчитать количество вещества щелочи.
Давайте вспомним формулу для малярной концентрации.
С натриуаж это что такое?
Это ню натриуаж.
Зеленый на объем раствора.
Обязательно проверяйте, чтобы у вас совпадали размерности, потому что малярная концентрация – это моль на литр, а у вас объем дали в миллилитрах.
Обязательно нужно переводить в этом случае миллилитры в литры.
Тогда крест-накрест количество вещества щелочи.
Это С на В. Тогда подставляем 6,095 умножаем на объем в литрах 0,328 и 11.
То есть разделили литры на 1000.
6,095 умножить на 0,325.
8, 11.
У меня получилось 1,99.
Ну, 100% можно округлить до двойки.
Получается 2 моль.
Точно.
А что еще?
Поскольку нам дальше что-то говорят про уменьшение массовой доли, нам нужно знать, какая массовая доля была изначально.
А для того, чтобы ее найти, нужно знать начальную щелочь.
Мы умножаем количество вещества на малярную массу, и это получается 80 граммов.
И нужно знать массу раствора.
А что для этого у нас есть, чтобы найти массу раствора?
Есть плотность.
И вот как раз то, что нужно ожидать от экзамена в этом году, это, скорее всего, просто дополнительные действия для того, чтобы искать массу раствора, может быть, массовую долю, еще что-то.
Но это несложно, это просто долгое.
Поэтому имейте в виду, что тут все отработано.
Плотность раствора это масса на объем.
Тогда масса раствора щелочи из этой формулы это произведение плотности на объем.
Опять же, проверяйте размерности.
Плотность у нас грамм на миллилитр.
Значит, подставляем миллилитры.
328 и 11.
Сколько у вас получилось?
У меня получилось вот столько.
1, 2, 1, 91 умножить на 328 и 11.
3, 9, 9, 9, 9.
Я думаю, это 400 граммов.
Тут можно смело округлять.
До 400.
Молодцы.
Тогда какая массовая доля у нас была изначально?
Омега-1 или просто омега?
Как больше нравится.
Ну, пусть будет омега-1 начально.
Это масса 80 делена на массу раствора 400.
80 делена на 400.
Получается 0,2%.
Точнее, 0,2 в процентах 20%.
Отлично.
Тогда, если начальная была 20%, тогда конечная чему будет равна?
В 4 раза меньше.
Тогда омега-штрих натрию АЖ.
Давайте здесь в процентах тоже укажу 20%.
Тогда нам нужно будет 20 разделить на 4, и это получается 5%.
Да?
Отлично.
Тогда что дальше?
Если вы знаете массовую долю начальную, вы знаете массовую долю конечную, к чему это?
К тому, что щелочь была в избытке.
И значит, что мы будем с вами делать на массовую долю конечную?
Это стандартный момент.
Где ответы в чат?
Уравнение с неизвестной?
Конечно.
Но вот давайте распишем эту омегу-штрих.
Из чего она будет выражаться?
Омега-штрих натриуаж.
Это масса начальной щелочи, которую мы только что посчитали.
Минус масса прореагирующей щелочи.
которая вступает в третью реакцию, которую мы не знаем, но, судя по всему, будем выражать.
Делена на массу конечного раствора.
А что такое масса конечного раствора?
Это масса начального раствора щелочи, которую мы, опять же, только что посчитали.
И плюс газы, которые поглощаются.
А поглощаются газы только образованные по второй реакции.
Мы это понимаем по соотношению, что это NO2 и это кислород по второй реакции.
А вот это вот все связано почему?
Это связано по третьему уравнению.
Поэтому давайте введем неизвестные.
Что нам удобнее за неизвестным будет ввести?
Вот я бы ввела кислород, если честно.
Потому что потом удобно умножить на 4 и будут там 4х и т.д.
Давайте.
Пусть.
Количество вещества кислорода по второй реакции это хмоль.
Тогда смотрим на уравнение реакции.
Если этого будет х, NO2 в 4 раза больше 4х.
И неважно, как вы будете считать здесь или по третьему уравнению реакции.
Видите, соотношение одинаковое.
Поэтому полностью NO2 реагирует с кислородом именно по второй реакции.
И щелочи будет тоже в 4 раза больше 4х.
Пишем тогда ν про реагирующие щелочи.
Равно количество вещества NO2.
И равно 4х моль.
Поскольку у нас массовая доля, нам нужно подставлять массы.
Считаем массу прореагирующей щелочи.
Через неизвестную.
Это количество вещества на малярную массу 160х грамм.
Затем масса NO2.
То же самое.
Количество вещества на малярную массу 4х на 46.
Это уже я в уме, считать не буду.
Получается 184х грамма.
И потом кислород.
Именно по второй реакции.
М2 кислорода.
Количество вещества на малярную массу 32х грамм.
Еще раз, 5% из условия задания, потому что нам сказали по условию задания, что массовая доля гидроксида натрия в растворе уменьшилась 4 раза.
Поэтому мы, найдя начальную массовую долю 20%, можем найти конечную, то, что получилось после третьей реакции.
20 на 4 это 5%.
Второе, почему мы складываем газы?
Потому что они поглощаются.
У нас же масса конечного раствора складывается из всего того, что перешло в раствор.
А это начальная щелочь и газы, которые в итоге поглотились.
И опять же, поглощаются только NO2 и кислород по второй реакции.
Кислорода по первой реакции NO2 не хватает.
Поэтому это газ, который не будет входить в состав конечного раствора.
Я ответила на ваши вопросы?
Идем дальше.
Все, подставляем в омегу-штрих.
Тогда начальная щелочь у нас там сколько была с вами?
Это 80.
Минус прореагирующая щелочь 160х.
Деленная на массу конечного раствора.
А это начальная щелочь 400.
И плюс газы, которые поглощаются.
Поэтому с плюсом, конечно же.
Мы же их пропускаем.
184х.
плюс 32х, и все это равно 5%, то есть 0,05.
Что нужно сделать?
Преобразовать, решить, написать х в ответы, в комментарии, в чате.
Раскрываем пропорцию крест-накрест.
Получается, что 80 минус 160х равно 0,05, умножаю на скобку 400 и преобразую.
184 плюс 32, это получается 216х.
216х.
И раскрываем скобки.
80 минус 160х равно... 0,05 умножить на 400.
Это получается 20 плюс...
0,05 умножить на 216 – это 10,8х.
Тогда цифру сюда с противоположным знаком, х сюда с противоположным знаком.
80 минус 20 – это 60.
А здесь получается 10,8 плюс 160.
Могу себе позволить на калькуляторе это считать.
170 и 8х.
Тогда х получается 60 деленное на 170 и 8.
Давайте смотреть, что получается.
У меня получилось вот столько примерно.
0,35.
0,35.
Потому что там дальше 1,3.
Вполне себе можем округлить до 0,35.
Согласны?
Тогда что мы обозначали за х?
ν2 кислорода.
0,35 моль.
И это именно вторая реакция.
Ну и дальше можем сделать расчеты все остальные.
А что мы хотим?
Мы хотим начальный нитрат.
Поэтому если мы знаем, что кислорода по второй реакции у нас 0,35, тогда ν2 у нас получается 0,35 на 4 моль.
Это 1,4.
И тогда через вот оставшиеся данные мы сможем найти кислород по первой реакции.
Задача решена.
Сколько нитрата бария получается по второй реакции?
Напишите в чате.
В два раза меньше, чем NO2 и в два раза больше, чем кислорода.
Как вам больше нравится, так и считайте.
Но если в два раза больше, чем кислорода, то 0,7 моль.
Это ν2.
Надо еще найти ν1.
Тогда что?
Вот используем это соотношение.
А соотношение объёма газов то же самое, что что?
Я должна сейчас искать объём смеси?
Или я могу что-то другое подставить туда?
Это моль, конечно, потому что есть газовый закон, что у нас количество вещества для газов прям пропорционально объему.
Ну, потому что малярный объем – это константа.
Поэтому у нас есть вот такое соотношение.
И вот это вот соотношение – это то же самое, что соотношение количества вещества.
ν1, деленное на количество вещества смеси, равно 1,8.
1 к 8.
Тогда выражаем ν1 кислорода.
Крест-накрест, да, это ν смеси.
деленное на 8 они смесь это что такое но это получается исходной смеси газов то есть это все да это и кислород по 1 реакции и на 2 и кислород по 2 реакции здесь придется все-таки через неизвестную работать ну давайте скажем что
NU1 это какой-нибудь Y. И распишем вот это соотношение.
Ну или можно даже не обязательно обозначать за Y. Можно просто NU1 оставить.
Только смесь давайте распишем.
Что это по первой реакции.
То есть NU1 сюда входит.
Это NUNO2.
И NU2 кислорода.
То есть тогда у нас ν1 кислорода здесь так и останется.
ν1 кислорода тут так и останется.
NO2 у нас получился с вами 1,4.
И кислород по второй реакции 0,35.
И вот это вот все равно 1,8.
Значит, надо преобразовывать.
Тогда получается крест-накрест.
8ν1О2 равно...
НЮ1О2 плюс 1,75.
Тогда переносим вот это сюда с противоположным знаком.
То есть получается 7 НЮ1О2 равно 1,75.
Тогда НЮ1О2 это 1,75.
Деленное на 7.
Получилось?
У меня получилось 0,25.
Ну, похоже на правду.
Моль.
Размерность не забываем.
Все.
Конец.
Тогда что?
Если мы знаем кислород по первой реакции, тогда мы можем найти нитрат по первой реакции.
Тогда в сумме нитрата сколько?
0,7 плюс 0,25.
Задача решена.
Какой у вас финальный ответ?
Давайте напишем, что тогда суммарное количество вещества нитрата бария, барий NO3 дважды, это 0,25, это то, что получилось по первой реакции, и 0,7, то, что по второй.
0,95 моль.
Тогда масса нитрата бария начальная, это количество вещества,
на малярную массу.
А нитрата бария это 261.
Ну проверяем.
У меня получилось вот столько.
247,95 грамма.
Задача решена.
Как-то так.
Вопросы?
В чём тут прикол?
Прикол, опять же, в параллельном разложении.
Прикол ещё в том, что задача была без малярной концентрации, я её сама исправила на малярную концентрацию, и от этого она стала как будто бы чуть-чуть пикантнее, что тут нужно было самостоятельно посчитать массовую долю, потому что в оригинальном массовая доля была дана.
И ещё одна очень важная мысль.
Это то, что здесь так просто получилось, и это нужно увидеть, это нужно заметить.
То, что соотношение газов по второй реакции в точности такое же, как и по третьей реакции.
И вот газы, которые выделились по второй, они полностью прореагировали, а газ, который у нас выделялся по первой, вот он остался непрореагирующий.
И поэтому через это соотношение мы нашли именно газ, который получился по первой реакции.
Ну а дальше довольно-таки стандартные расчеты.
Вы знаете массовую долю конечную, вы составляете уравнение с неизвестной, вы знаете какие-то соотношения, вы опять же составляете уравнение с неизвестной.
И все остальные элементы для нас уже знакомы.
Митрат Барри полностью прорегировал, как понять...
Потому что сказали твердый остаток, состоящий в смеси оксида бария и нитрита бария.
То есть не сказали оксид, нитрит и оставшийся нитрат, как было, например, в предыдущей задаче.
То есть здесь имели в виду, что нитрат полностью разложился, но разлагается по-разному.
Как запуск легко, так как много где газа есть.
Ну, конечно, везде легко запутаться.
Надо не запутаться, надо распутаться.
До сроков по ситуации пока не знаю.
Округления тут тоже не очень симпатичные.
Ну, что поделать.
Такое бывает.
Не всегда красивые значения.
И самое главное, что вы должны понять, если у вас правильное округление с точки зрения математики, если у вас правильный ход решения, даже если вы округляли там до десятой, а не до сотой, у вас все равно будет максимальный балл, потому что все правильно.
Даже если финальный ответ на сколько-то там отличается, не страшно, будет максимальный балл, потому что все остальное правильное.
Поэтому ответы могут расходиться, это нормальная ситуация.
Почему массу бурого газа и кислорода в раствор щелочи включаем?
А как вы думаете сами?
Почему включаем?
Потому что массовая доля штрих щелочи дана для конечного раствора.
То есть раствора, получившимся после этой реакции.
И тогда она считается как?
Масса оставшейся щелочи делена на массу конечного раствора.
А конечный раствор это масса начального раствора плюс газы, которые пропускаются.
Как-то так.
Ну всё, поздравляю, товарищи.
Ещё одна задачка в копилку.
И вот я очень хочу, чтобы, когда мы с вами разбираем задачи, опять же, задач стало так много, что просто трэш.
И я не знаю, что будет на экзамене.
Но я всегда прошу вас подмечать какие-то интересные моменты и вот реально собирать это в коллекцию.
То есть у вас должна быть коллекция интересных моментов 34-х задач.
Скорее всего, на экзамене у вас будет что-то из этих моментов.
Навряд ли будет что-то кардинально отличное.
Следующая задача тоже на параллельное.
Хотя тут не совсем параллельное.
Здесь просто разложение, но с протонами.
Протоны мы любим или не любим?
Напишите в чате.
Как у вас там дела с протонами?
Итак, что говорят?
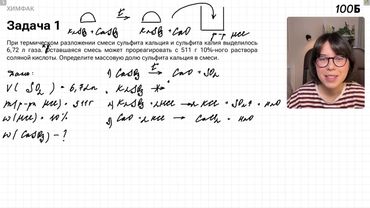
Смесь нитрата магния и нитрата серебра, в которой масса протонов ядерных всех атомов составляет столько процентов от общей массы смеси, прокалили до постоянной массы.
Не любите.
Ну, надо полюбить.
Бьет, значит любит.
Если протоны вас бьют, значит любят.
Значит, и вы тоже должны полюбить.
Давайте как раз-таки разбирать еще раз алгоритм, потому что мы не первый раз с вами встречаемся с протонами.
И, в принципе, тут надо просто отработать.
Итак, у нас есть массовая доля протонов в ядрах всех атомов.
То есть массовая доля протонов 48,32%.
От общей массы смеси проклеили до постоянной массы.
Какое тут есть интересное словосочетание, которое вам будет подсказывать, а как именно протекают реакции?
то это очень важно.
Если до постоянной массы, это означает, что реакции идут до конца.
То есть тут у вас точно не возникает вопросов, все разложилось, не все разложилось.
То есть в предыдущей задачке было понятно, что все разложилось, потому что нам сказали состав твердой смеси после разложения.
И там нитрата нет, ну значит до конца.
А здесь до постоянной массы.
Значит, всё, что могло разложиться, всё разложилось.
То есть тут условно никакого там нитрита магния образовываться не может, потому что он точно дальше разложится.
Поэтому тут 100% конечный продукт.
Идём дальше.
Выделившуюся смесь газов пропустили через воду.
У нас есть объём воды, но мы сразу понимаем, что в принципе это и масса воды.
При этом объем непоглотившегося газа составил столько-то литров при нормальных условиях.
Допустим, мы пока не понимаем, что там за газ.
Оставим место 13,44 литра.
Вычислите массовую долю растворенного вещества в образовавшемся растворе.
Не понимаем, какое там растворенное вещество.
Оставим место, потом подпишем.
Пишем реакции.
Нитрат магния.
магний и внутри дважды разлагается до постоянной массы будут точно не аккуратное разложение тут если до постоянный то до оксидов и кислорода магний о и на 2 плюс кислород чтобы уравнять сделать учетный кислород тут тогда сюда вы поставите двойку сюда поставить четверку но здесь единичка остается а нитрат серебра как разлагается и
А у серебра неустойчивый оксид, поэтому он в таких реакциях, конечно же, получиться не может.
И он будет дальше разлагаться с образованием металла, NO2 и кислорода.
Тогда давайте поставим сюда двойку, сюда двойку, сюда двойку.
И все уравнялось.
Что дальше?
Потом смесь газов пропускает через воду.
Вот у нас идет разложение.
Здесь у нас получается по первой реакции магний О, NO2 плюс кислород.
По второй реакции серебро, NO2 и кислород.
И опять же, дальше у нас участвуют только газы.
То есть мы только на них смотрим.
Именно их поглощают, больше ничего не поглощают.
Пропускать через воду.
Тут будет какая-то реакция, как вы думаете?
Или не будет?
Или просто растворили вещества?
Будет, потому что NO2 с кислородом и с водой, конечно, это реакция.
То есть если бы не было бы кислорода, то NO2 бы диспропорционировал, а в присутствии кислорода он окисляется до максимума, до 5, поэтому получается азотная кислота.
И это последняя стадия получения азотной кислоты в промышленности.
Точно.
Коэффициенты по балансу.
Кислород 4 электрона принимает, поэтому сюда поставим 4, сюда поставим 4, здесь единичка, здесь будет двоечка.
Как вы думаете, какой непрореагирующий газ в итоге у нас останется?
Если мы опять смотрим на все эти реакции.
Например, вот тут у нас идеальнейшее соотношение, чтобы все, что получилось по первой реакции, все потом у нас реагирует с водой и получается азотная кислота.
Как в предыдущем случае, здесь точно такие же особенности.
Такое же соотношение, поэтому по первой реакции все точно прореагировало.
А по второй реакции...
У нас здесь соотношение не 4 к 1, а 2 к 1.
То есть кого в итоге будет больше?
Давайте чисто гипотетически подумаем, что, например, кислорода у нас х. NO2 тогда получится 2х.
По реакции.
А здесь нужно соотношение 4 к 1.
Предположим, что у вас будет 2х на 2, но кислород будет в 4 раза меньше, а 2 на 4 это 0,5.
0,5х.
То есть из этих х кислорода нужно для этой реакции только 0,5.
Тогда что?
Тогда кислород.
Опять же, я это сделала просто, чтобы прикинуть математику.
То есть это не обязательно было делать.
Вы можете это и так понять, что все-таки кислорода у нас в небольшом избытке.
И в итоге ему не хватит 2 по 2 реакции, чтобы по 3 дать азотную кислоту.
Поэтому вот этот оставшийся кислород, ну вот это кислород именно, оставшийся газ.
Можно его как-то там обозначить, или объем оставшегося кислорода, или ваш штрих, как хотите.
А какое у нас растворенное вещество получилось?
Это азотная кислота.
Поэтому мы с вами должны потом найти массовую долю азотной кислоты.
А для того, чтобы ее найти, нужно знать количество вещества азотной кислоты, а мы это 100% будем делать через газы.
И нужно знать массу конечного раствора.
А масса конечного раствора – это масса воды, которая у нас есть.
Это 800 граммов и масса газа, который будет пропускаться.
Ну, как-то так.
Тогда что мы будем сейчас с вами делать?
Работать с протонами?
А тут все есть для работы с протонами?
У нас есть смесь нитрата магния и нитрита серебра, которая масса протона в ядрах всех ада составляет столько-то.
Угу.
Но это похоже на уравнение с двумя неизвестными.
А массу смеси нам, кстати, тут не дали.
Ну, значит, что-то придется считать самостоятельно.
У нас есть этот объем непоглотившегося газа.
Скорее всего, здесь еще на это что-то мы завяжем.
И у нас в итоге будет уравнение с двумя неизвестными.
Ну, погнали.
Чего сидим?
Пишем.
Пусть.
Количество вещества нитрата магния.
Х-моль.
Количество вещества аргентум NO3.
Это Y. Тогда что?
Тогда мы будем считать протоны.
Потому что у нас нет массы смеси.
Но ее не дали.
Значит, все будем считать через неизвестные.
А тогда давайте распишем, что массовую долю протонов
что это масса протонов из нитрата магния, магний NO3, дважды, плюс масса протонов из нитрата серебра, аргентум NO3, и делена на массу смеси.
Но масса смеси в данном случае тоже будет как неизвестная.
То есть из этого выражения мы сможем сделать уравнение с двумя неизвестными.
Конечно, здесь придется долго все это преобразовывать, но что ж поделать.
Какую дали, такую решаем.
Деленная на массу смеси, на массу солей.
Все с этим согласны?
С этим вопросов нет?
Да, еще раз.
Массовая доля протонов – это масса протонов.
А масса протонов у нас из двух солей, из нитрата магния и нитрата серебра.
Деленная на массу смеси.
А смесь – это нитрат магния и нитрат серебра.
Давайте выразим для начала, что просто, массу солей.
Тогда масса нитрата магния, магний NO3 дважды.
Это получается 148 х грамм.
Масса нитрата серебра.
170 Y грамм.
Это знаменатель.
А теперь долгое веселье с протонами.
Что нужно помнить?
Что протоны равны чему?
Порядковому номеру элемента.
Поэтому мы достаем таблицу Менделеева и смотрим таблицу Менделеева.
Сначала мы будем с вами считать количество протонов в нитрате магния.
Магний Н3 дважды.
Сначала считаем в одной штуке.
И это штуки протонов из одного магния.
плюс штуки протонов из двух атомов азота и штуки протонов из шести атомов кислорода.
С этим все согласны, потому что у нас один атом магния, два азота и шесть кислородов.
Еще раз, количество протонов равно порядковому номеру, поэтому подставляете просто порядковый номер.
У магния у нас порядковый номер 12, у азота 2 на 7,
И у кислорода это 6 на 8.
Сколько протонов у вас получилось в одной штуке соли?
13 плюс 2 на 7 плюс 6 на 8.
У меня получилось 74.
Супер.
У вас тоже.
Это в одной штуке.
А у вас было х-моль.
Ну, значит, в х-моль раз больше.
Да?
То есть можете пропорцию составить, что вот если у меня одна штука, то 74 протона, а если у меня будет x моль.
Тогда какое будет количество вещества протонов в нитрате магния?
Магний НО3 дважды.
Все по классике, это пропорция.
Раскрываете пропорцию крест-накрест.
Тогда именно количество вещества протонов, а вам нужно количество вещества, потому что вы массу хотите найти, вам штуки эти не нужны.
Из них массу никак не вытянуть.
В х раз больше.
То есть 74 х моль.
А как найти массу?
А для этого нужно вспомнить, что протон по факту это малярная масса водорода, потому что водород это электрон и протон, но поскольку у электрона масса пренебрежима мала, то у протона малярная масса единица.
То есть малярная масса 1 грамм на моль, это я пишу для вас, чтобы вы вспомнили, для экспертов писать это не обязательно.
И получается, что тогда масса протонов магний-НО3 дважды
Это получается 74 х грамма.
Все с этим согласны?
Давайте сделаем перекличку.
У всех получилась такая масса протонов из нитрата магния.
Все, это наше первое действие.
А теперь то же самое нужно будет сделать для нитрата серебра.
Сделайте это, пожалуйста, быстрее меня.
Что протоны в одной штуке аргентумы внутри...
Это протоны из одного атома серебра плюс протоны из одного атома азота и плюс протоны из трех атомов кислорода.
И подставляем.
У серебра порядковый номер 47, у азота 7 и 3 на порядковый номер кислорода 8.
Получается 47 плюс 7 плюс 3 на 8.
Это 78.
Получилось.
Тогда получается, что количество вещества протонов в аргентумы внутри в у раз больше.
То есть это будет 78 у моль.
А масса протонов из аргентумы внутри это будет 78 у грамм.
Соответственно, обращайте внимание на размерность.
Но здесь я уже не буду так подробно это расписывать, зачем, если вы уже один раз это написали.
Все.
Тогда мы все эти значения можем подставить в омегу протонов, в массовую долю протонов.
Получается что?
Массовая доля протонов.
Еще раз, это масса протонов из соли.
Из нитрата магния 74х, из нитрата серебра 78у и делены на массу смеси.
А масса смеси это масса нитрата магния.
И это 148х.
И нитрат серебра это 170у.
И все это у нас получается равно 0,4832.
это божественное выражение надо преобразовать.
То есть все равно мы его в таком варианте не будем использовать.
Давайте раскрывать тогда пропорцию и преобразовывать.
Крест-накрест 74х плюс 78у равно 0,4832 на 148х плюс 170у.
Аккуратно раскрываем скобочки.
Получается 74х плюс 78у равно 0,4832 на 148.
Получается 71,51х плюс 0,4832 на 178.
Примерно 82 и 14у.
Тогда у сюда с противоположным знаком, х сюда с противоположным знаком.
И что у нас в итоге в конечном счете остается?
Здесь получается 4,14у.
А здесь тогда получается 74 минус 71,51.
2,49у.
Ну, конечно, можно дальше что-то сделать, там, я не знаю, х выразить как один из вариантов, почему бы и нет.
Давайте выразим.
Тогда 4 и 14 нужно разделить на 2,49.
Ну, и получается примерно там 1,66у.
Ну, и, конечно, это только первое уравнение, нам нужно найти второе.
Перекличка.
С этим всем понятно?
Только там 1.66, там же после шестерки двойка.
Откуда у вас 1.67?
У меня не получилось 1.67.
1.66?
Нет?
Давайте перепроверим еще раз.
Может, конечно, вы что-то поточнее взяли?
Ну, давайте ещё раз.
А если 1, 4, 4, 4, зелёный на 2, 49?
Да нет, уже 1, 66.
Так что посмотрите, потому что у меня так.
Тогда что дальше?
Дальше нужно развлекаться с газами.
С газами, конечно, веселее развлекаться, то есть нужно разобраться с этим оставшимся кислородом.
Давайте подпишем всё над уравнениями реакций.
Нитрата магния было х. NO2 тогда получается в 2 раза больше.
2х.
Кислорода тогда будет в 2 раза меньше.
То есть 0,5х.
Согласны?
И вот это прореагировало полностью.
Потому что здесь прям соотношение совпадает.
Какое здесь, такое и тут.
Это все вступило.
С нитратом серебра.
Этого у.
Тогда NO2 получается Y. Здесь кислорода в два раза меньше 0,5Y.
И теперь представьте ситуацию, что по третьей реакции у вас соотношение 4 к 1, не 2 к 1, а 4 к 1 соотношение меняется.
То есть вот эти вот все прореагировали по третьей реакции, а по второй не все.
Кто в итоге в избытке?
Кислород.
Потому что представьте, если у вас NO2 будет Y, ну вот сколько здесь получилось, столько здесь и прореагирует.
А тогда кислорода нужно в 4 раза меньше.
А в 4 раза меньше это 0,25 У. То, что я показывала в начале задачки, это просто было от балды.
Просто из воздуха.
А сейчас у нас уже конкретные значения.
Уже то, что нужно для решения этой задачки.
Конкретной задачки.
Согласны?
Но у вас-то по этой реакции получается 0,5.
А здесь требуется 0,25.
Ну тогда что?
У нас оставшийся газ это кислород, и значит не весь кислород в итоге прореагирует, который получился по второй реакции.
И вот как раз вот это и есть путь к тому, чтобы найти одну из неизвестных.
Ну что мы с вами в любом случае сделаем?
Давайте посчитаем количество вещества, оставшееся кислородом, потому что это то, что мы точно можем посчитать.
И это объем, деленный на малярный объем.
Объем у нас был 13,44.
На 22,4.
Слушайте внимательно, я же все проговариваю.
Ушки на макушках.
0,6 моль.
Согласны?
И чему это будет равно?
Напишите в чате, пожалуйста.
Вот это оставшееся.
Но судя по вот этим вот выражениям, что если у нас по второй реакции получилось 0,5 Y, по третьей реакции прореагирует 0,25, тогда останется 0,25.
Да?
0,25 Y. И это равно вот этому значению 0,6.
Давайте запишем, что у него оставшегося кислорода
Это получается ν2 кислорода, который получился по второй реакции, и минус ν прореагирующего кислорода по третьей реакции.
Можно ν3 обозначить, например.
Когда получается это 0,5у минус 0,25у, и это равно 0,25у моль.
Подставляем, тогда получается, что 0,25у равно 0,6.
Тогда у у нас получается 0,6 деленное на 0,25.
Это 2,4.
2,4.
И что это у нас у был?
У – это изначально вообще было количество вещества нитрата серебра.
Аргентума на 3.
2,4 моль.
И теперь мы можем найти х. Мы же х выражали в итоге.
Да, это 1,66 у. Значит, мы подставляем.
И получается 3,98.
Ну, может быть, до 4 округлим.
Потому что, конечно, если бы мы вообще не округляли, то еще было бы поточнее.
Можно оставить 3,98.
Но можно округлить и до 4.
Я бы округлила до 4, если честно.
Пусть будет 4.
Тогда количество вещества нитрата магния... 4 моль.
Ну все.
Мы практически все решили.
Что нам осталось с вами найти?
Нам нужно найти азотную кислоту.
А для этого нужно знать, сколько газов где получается.
Тогда, если х у нас 4 моль, n2 в 2 раза больше, то это будет 8 моль.
Если у нас получилось 2,4 моль, тогда здесь оно столько же, то получается 2,4 моль.
мы можем посчитать по недостатку.
То есть в сумме NO2 по третьей реакции это вот этот вот и вот этот вот.
То есть 2,4 плюс 8 это получается 10,4.
А азотной кислоты ровно столько же.
То есть тоже будет 10,4 моль.
Согласны?
Давайте напишем, что у нас суммарное количество вещества NO2 это получается ν1
8 моль плюс ν2 2,4 – 10,4 моль.
И значит, у азотной кислоты в точности такое же количество вещества по уравнению реакции.
Мы просто делаем расчет по уравнению реакции.
Тоже 10,4 моль.
Тогда масса азотной кислоты – это числитель для массовой доли.
Да же?
Получается масса H3.
Это количество вещества 10,4 на малярную массу 63.
Множить на 63.
Получается 655,2 грамма.
Но нужен еще и знаменатель.
Для того, чтобы посчитать массовую долю.
А это масса раствора.
Чему будет равна масса раствора?
С чего она будет складываться?
Куда смотреть?
На картинку.
Смотрим на картинку.
Что у вас была вода.
800 мл это 800 граммов.
И через нее пропускает смесь газов.
И вот этот раствор для нас конечный раствор.
При этом твердые вещества в раствор никак не попали.
Обратите внимание, через воду пропускают только газы.
Пишем.
Получается, что тогда это масса воды.
плюс масса NO2, потому что NO2 точно полностью поглотился, и именно прореагирующий кислород.
Потому что у нас есть кислород, который в итоге не прореагировал, и его учитывать нам не нужно.
Но я вот так вот напишу, масса прореагирующего кислорода.
Вот это мы пока не знаем, но можем легко найти.
Получается, что масса NO2 – это количество вещества, то, что мы писали, 10,4, то есть это весь NO2 на малярную массу на 46.
10,4 умножить на 46, получается 478,4 грамма.
А как найти количество вещества, прорегировавшего кислорода?
Да можно найти через NO2.
Это самый простой способ.
То есть получается, что количество вещества тогда…
прореагирующего именно кислорода, по третьей реакции.
Это количество вещества NO2, деленное на 4, в 4 раза меньше.
То есть 10,4 мы разделим на 4, получается 2,6 моль.
То есть не чтобы нам как-то там складывать, что-то там потом вычитать, то, что не прореагировало.
А мы просто делаем расчёт про равнение реакции.
Вы же знаете, что вот сколько N2 было, да, кислорода в 4 раза меньше.
Вот это точно то, что прореагирует, то, что окажется в конечном растворе.
Тогда масса кислорода, прореагирующего, это количество вещества 2,6 на малярную массу 32.
Получается 83,2 грамма.
Тогда массу конечного раствора подставляем.
Масса воды это 800 граммов.
Масса NO2 478,4 и прорегирующий кислород 83,2 грамма.
Тогда 478,4 плюс 800.
Масса конечного раствора у меня получилась 1361,6 грамма.
Ответ пишите в чате.
Массовая доля азотной кислоты.
Это масса азотной кислоты 655,2.
Зеленая на массу раствора 1361,6 грамма.
Так, 6, 5, 5, 2.
Получается вот столько.
0, 48, 11.
Да, даже не 11, а 12.
Потому что там после единички девятка точно округляем в большую сторону.
48,12.
4 из 4 баллов.
Молодцы.
Я готова отвечать на вопросы.
У матросов есть вопросы?
Как вам последняя задача?
Веселая?
Достаем двойные листочки.
Самостоятельная работа.
Если мы сегодня оперативно.
Ну, ребят, если вы запутались, я сейчас нового ничего не скажу, мне нужны конкретные вопросы.
То есть вы просто можете отложить эту задачку, и это нормально, что вы запутались, потому что задача сложная.
Отложить, поспать, вернуться на следующий день, попытаться решить ее еще раз самостоятельно.
Не получилось, значит, еще раз послушать разбор, потому что все, что нужно для понимания, я проговорила.
И так делать пока не получится, и вы обязательно распутаетесь.
Ещё раз в соотношении прорегируешь-не прорегируешь у газовой реакции объяснить.
А что конкретно?
Ну, то есть, вам не было понятно про оставшийся кислород?
Мы это посчитали через вторую реакцию.
То есть, если у нас нитрат из серебра был Y, тогда NO2 получается тоже Y. А кислорода по второй реакции тогда будет в 2 раза меньше, 0,5Y.
Но для третьей реакции нам же нужно другое соотношение.
Нам нужно 4 к 1.
Если здесь мы берем NO2Y, тогда кислорода требуется именно для третьей реакции, именно для образования азотной кислоты в 4 раза меньше.
Это 0,25Y.
Тогда получается, что если столько образовалось, а столько прореагировало, тогда осталось 0,5 минус 0,25у.
0,25у.
И это мы использовали для того, чтобы посчитать одну из неизвестных.
Вот этот момент.
Мы посчитали, что у – это 2,4, и это количество вещества нитрат серебра.
А все, что касается нитрата магния, это все было с протонами.
Мы выразили в итоге массовую долю протонов, долго, нудно, преобразовали выражение, выразили х, потом посчитали у через оставшийся газ, подставили, нашли х, нашли нитрат магния и довели задачу до конца.
Как мы поняли, что по первой реакции все газы прореагировали?
Так же, как и во второй задаче.
Во второй задаче было понятно, что все газы прореагировали?
Если да, то тут то же самое.
Еще раз, соотношение.
То есть здесь у вас соотношение 4 к 1, так и здесь тоже соотношение 4 к 1.
То есть что здесь получилось, здесь прореагировало с водой, с образованием азотной кислоты.
А вот тут вот соотношение у нас было другое.
Поэтому мы делали перерасчет.
Да, что у нас в итоге чуть-чуть кислорода осталось непрореагирующего.
Потому что для третьей реакции его нужно меньше, чем образуется по второй реакции.
Я не буду комментировать слова Марка, он сильный.
Насчёт самого сильного не знаю, сравнивать разные предметы довольно-таки сложно.
Все предметы в стубальном и все преподаватели, все сильные.
Почему в третьей реакции мы считаем через Y, почему не учитывали X?
Мы считали через y, потому что там нужно было сделать перерасчет.
x-то мы в итоге учитывали потом.
То есть, когда мы уже считали весь, оно 2, конечно, мы считали и по первой, и по второй реакции.
Но чтобы понять именно, сколько у нас осталось непрореагирующего кислорода, здесь я подставляла y, чтобы именно это пересчитать.
Потому что это-то все прореагировало.
Зачем мне туда x-ы подставлять, чтобы найти оставшийся кислород?
Не надо.
Потому что оставшийся кислород, он именно из второй реакции в итоге окажется.
А как бы потом, уже когда мы доводили задачу до конца, мы считали весь NO2.
Конечно, это было X и Y. И всего NO2 у нас получилось 10,4, ну и азотной кислоты 10,4.
Как понять, когда смотреть по коэффициенту, когда мыслить как в третьей?
Не очень поняла.
Мы везде смотрели по коэффициентам.
Единственное, где мы не смотрели, это в первой задаче, потому что там это не требовалось.
Очень много вопросов, просто не успеваю уже.
Как мы поняли, что NO2 полностью в третьей реакции прореагировал и не остался.
Ну, потому что его получается меньше, чем кислорода.
Здесь ровно столько, сколько нужно.
Здесь нет сомнений, что он полностью прореагировал и кислород полностью прореагировал.
А здесь у нас NO2, если через соотношение мы делаем перерасчет, меньше.
Кислорода больше в итоге оказывается вот тут вот.
Кислорода здесь меньше нужно.
Поэтому 100% полностью прореагировал.
Ну, ребят, я уже как попка дурак повторяю одно и то же.
Ну, почему мы поняли, что по первой реакции полностью?
Потому что, смотрим, 4, 4, 1, 1.
Они совпадают.
Ну, то есть, как бы, что в первой, что в третьей реакции соотношение одинаковое.
Значит, все, что по первой реакции, оно все прореагировало.
А по второй?
А по второй не совпадает.
Поэтому то, что я написала здесь игреки, это как раз таки, чтобы вот с этим разобраться.
И мы поняли, что если 2у, тогда кислорода же в 4 раза меньше.
И мы посчитали, сколько осталось.
Мы уже много раз повторили одно и то же, ребят.
И так, и сяк, и сверху, и снизу, и сбоку.
Поэтому вы знаете, как нужно работать с задачами.
То, что непонятно с первого раза, но это уже наше стандартное перманентное состояние, правда?
Не вы первый, не вы последний.
Они объективно сложны.
Поэтому оставьте ее на следующий день, посмотрите потом на нее свежим взглядом, попробуйте перерешать самостоятельно, вытащить вот эту всю информацию с головы, то, что мы сегодня с вами все говорили.
А потом, если будет еще раз непонятно что-то, вы не сможете вытащить.
Потом еще раз пересмотрите, еще раз послушайте.
Потому что то, что я сейчас говорю одно и то же, ну, на самом деле, от этого никому ни холодно, ни жарко.
От этого пользы ноль.
Вам нужно самому подумать.
Потому что только когда вы сами думаете, а не вам разжеванно кладут в ротик, вот тогда нейронные связи образуются.
Поэтому не то, что мне лень говорить одно и то же.
Нет, ну просто нет конкретных вопросов.
Поэтому я советую пересмотреть завтра.
Договорились?
Ну, мы нашли оставшийся кислород.
У нас нельзя найти прореагирующий.
Как мы найдем прореагирующий?
Если вы про это.
Здесь же осталось какой-то объем.
Если вы про уравнение, которое мы в итоге составляли на Y, это только через вторую реакцию и через количество вещества оставшееся.
А то, что мы искали потом прореагирующий, это уже для финального раствора.
Конечно, это разные вещи.
То, что осталось, оно в раствор вообще даже и не попало, потому что оно в итоге не прореагировало с НО2.
А кислород не растворяется в воде, у него низкая растворимость.
Поэтому то, что здесь мы считали прореагирующее, это весь по первой реакции и частично по второй.
Потому что, опять же, часть прореагировала, часть не прореагировала.
Но просто чтобы 25 миллионов раз одно и то же не считать и не писать, я вам предложила сделать чуть покороче.
Потому что вы же знаете количество вещества N2, поэтому просто сделали расчёт по уравнению реакции.
Чтобы там ничего не вычитать, не просчитывать.
И просто 10,4 разделили на 4 и получили прореагирующий кислород.
А всё то, что не прореагировало, оно не входит в состав раствора.
Почему мы взяли NO2 за Y в трикотереакции?
Я уже много раз говорила.
Потому что то, что написано в реакции, это объяснение, почему у нас остался кислород.
Конечно же, в конечном растворе у нас NO2 10,4.
Откуда это взялось?
Мы же написали с вами, ребят.
10,4 это 8, это NO1.
И 2,4 – это ν2.
Я снизу подписала.
Ну, просто Y здесь я подписывала, чтобы объяснять про кислород оставшийся.
Если вас это смущает, можете где-то снизу написать.
Не пишите над реакцией.
Вот здесь я снизу обозначила весь NO2 – 10,4.
А с Y мы работали, потому что здесь были сложности с соотношением и с избытком и недостатком.
С тем, по крайней мере, сколько кислорода осталось и не осталось, поэтому там Y оказалось.
Ну, конечно, в конечном счете это и X и Y, да, то есть это 8 плюс 2 и 4, то есть 2X плюс Y.
Вот.
Тогда я вас отпускаю, товарищи, отдыхать.
Встречаемся на 34-х задачах в воскресенье в наше обычное стандартное время в 10.00.
Если я не ошибаюсь, у нас будут задачи... А на что у нас будут задачи?
Я не помню, если честно, на что у нас будут задачи.
На что-то будут, надо смотреть в расписании.
Какие-то интересные.
Но завтра мы встречаемся с вами на практике.
В четверг у нас мега-ультраважный урок по железу.
на которые нужно 100% всем прийти.
И, кстати, у нас заканчивается седьмой блок.
У нас это неделя, последняя неделя блока.
У нас на растворимость будут.
Это как раз еще одни задачи, которые были на ЕГЭ 2024 года.
Это как бы ЕГЭ 2022 года, но то, что попалось и 2024 года.
Поэтому решим на растворимость нескольких веществ, на растворимость газов, на более сложную растворимость и еще несколько типов задач будут в копилку.
Ждете азот?
Ну, ждите.
Азот будет в следующем блоке.
Все.
Ну, ладно.
Тогда всем пока-пока.
До завтра.
До 16.00.